|
Иммунитет: механизмы развертывания Клетки и молекулы действуют слаженно, поддерживая друг друга на разных этапах развития иммунного ответа. Неспецифические механизмы На первом этапе столкновения с чужеродным антигеном запускается неспецифический патологический защитный процесс — воспаление, сопровождающийся фагоцитозом, выделением медиаторов воспаления - гистамина, серотонина, цитокинов и т. п. Фагоциты (макрофаги) поглощают антигены и контактируют с лимфоцитами Т-хелперами, представляя им на поверхности антигенные детерминанты. Т-хелперы запускают размножение (выделяя специфические белковые вещества — интерлейкины) специфических для данного антигена клонов Т-киллеров и В-лимфоцитов из предсуществующих стволовых клеток, которые прошли проверку на толерантность в эмбриональном периоде (клонально-селекционная теория Бернета). Воспаление (лат. inflammatio) — это комплексный, местный и общий патологический процесс, возникающий в ответ на повреждение (alteratio) или действие патогенного раздражителя и проявляющийся в реакциях (exudatio и др.), направленных на устранение продуктов повреждения, а если возможно, то и агентов (раздражителей), а также приводящий к максимальному для данных условий восстановлению (proliferatio и др.) в зоне повреждения.
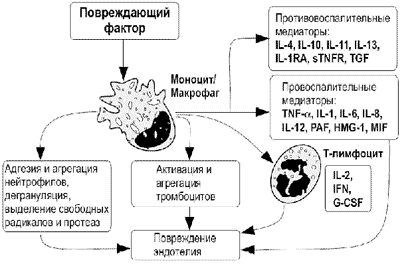
Схема развития воспаления. Под действием повреждающего фактора происходит выделение макрофагом провоспалительных цитокинов, которые привлекают в очаг воспаления другие клетки, в результате агрегации которых или выделения ими активных веществ происходит нарушение целостности ткани. Фагоцитоз (Фаго — пожирать и цитос — клетка) — процесс, при котором специальные клетки крови и тканей организма (фагоциты) захватывают и переваривают возбудителей инфекционных заболеваний и отмершие клетки. Осуществляется двумя разновидностями клеток: циркулирующими в крови зернистыми лейкоцитами (гранулоцитами) и тканевыми макрофагами. Открытие фагоцитоза принадлежит И. И. Мечникову, который выявил этот процесс, проделывая опыты с морскими звёздами и дафниями, вводя в их организмы инородные тела. Например, когда Мечников поместил в тело дафнии спору грибка, то он заметил, что на нее нападают особые подвижные клетки. Когда же он ввел слишком много спор, клетки не успели их все переварить, и животное погибло. Клетки, защищающие организм от бактерий, вирусов, спор грибов и пр. Мечников назвал фагоцитами.У человека различают два типа профессиональных фагоцитов: нейтрофилы и моноциты (в ткани - макрофаги) Основные этапы фагоцитарной реакции сходны для клеток обоих типов. Реакция фагоцитоза может быть подразделена на несколько этапов: 1. Хемотаксис. В реакции фагоцитоза более важная роль принадлежит положительному хемотаксису. В качестве хемоаттрактантов выступают продукты выделяемые микроорганизмами и активированными клетками в очаге воспаления (цитокины, лейкотриен В4, гистамин), а также продукты расщепления компонентов комплемента (С3а, С5а), протеолитические фрагменты факторов свертывания крови и фибринолиза (тромбин, фибрин), нейропептиды, фрагменты иммуноглобулинов и др. Однако, "профессиональными" хемотаксинами служат цитокины группы хемокинов. Ранее других клеток в очаг воспаления мигрируют нейтрофилы, существенно позже поступают макрофаги. Скорость хемотаксического перемещения для нейтрофилов и макрофагов сопоставима, различия во времени поступления вероятно связаны с разной скоростью их активации. 2. Адгезия фагоцитов к объекту. Обусловлена наличием на поверхности фагоцитов рецепторов для молекул, представленных на поверхности объекта (собственных или связавшихся с ним). При фагоцитозе бактерий или старых клеток организма хозяина происходит распознавание концевых сахаридных групп - глюкозы, галактозы, фукозы, маннозы и др., которые представлены на поверхности фагоцитируемых клеток. Распознавание осуществляется лектиноподобными рецепторами соответствующей специфичности, в первую очередь маннозосвязывающим белком и селектинами, присутствующими на поверхности фагоцитов. В тех случаях когда объектами фагоцитоза являются не живые клетки, а кусочки угля, асбеста, стекла, металла и др, фагоциты предварительно делают объект поглощения приемлемым для осуществления реакции, окутывая его собственными продуктами, в том числе компонентами межклеточного матрикса, который они продуцируют. Хотя фагоциты способны поглощать и разного рода "неподготовленные" объекты, наибольшей интенсивности фагоцитарный процесс достигает при опсонизации т.е. фиксации на поверхности объектов опсонинов к которым у фагоцитов есть специфические рецепторы - к Fc-фрагменту антител, компонентам системы комплемента, фибронектину и т.д. 3. Активация мембраны. На этой стадии осуществляется подготовка объекта к погружению. Происходит активация протеинкиназы С, выход ионов кальция из внутриклеточных депо. Большое значение играют переходы золь-гель в системе клеточных коллоидов и актино-миозиновые перестройки. 4. Погружение. Происходит обволакивание объекта 5. Образование фагосомы. Замыкание мембраны, погружение объекта с частью мембраны фагоцита внутрь клетки. 6. Образование фаголизосомы. Слияние фагосомы с лизосомами, в результате чего образуются оптимальные условия для бактериолиза и расщепления убитой клетки. Механизмы сближения фагосомы и лизосом не ясны, вероятно имеется активное перемещение лизосом к фагосомам. 7. Киллинг и расщепление. Велика роль клеточной стенки перевариваемой клетки. Основные вещества участвующие в бактериолизе: перекись водорода, продукты азотного метаболизма, лизоцим и др. Процесс разрушения бактериальных клеток завершается благодаря активности протеаз, нуклеаз, липаз и других ферментов, активность которых оптимальна при низких значениях рН. 8. Выброс продуктов деградации.
Фагоцитоз может быть: завершенным (киллинг и переваривание прошло успешно), незавершенным (для ряда патогенов фагоцитоз является необходимой ступенью их жизненного цикла, например у микобактерий и гонококков). Активация комплемента. Система комплемента работает как биохимический каскад реакций. Комплемент активируется тремя биохимическими путями: классическим, альтернативным и лектиновым путем. Все три пути активации производят разные варианты C3-конвертазы (белка, расщепляющего С3). Классический путь (он был открыт первым, но эволюционно является новым) требует антител для активации (специфический иммунный ответ, приобретённый иммунитет), в то время как альтернативный и лектиновый пути могут быть активизированы антигенами без присутствия антител (неспецифический иммунный ответ, врождённый иммунитет). Итог активации комплемента во всех трёх случаях одинаков: C3-конвертаза гидролизует СЗ, создавая C3a и C3b и вызывая каскад дальнейшего гидролиза элементов системы комплемента и событий активации. В классическом пути для активации С3-конвертазы необходимо образование комплекса С4b2a. Этот комплекс образуется при расщеплении С2 и С4 С1-комплексом. С1-комплекс, в свою очередь, для активации должен связаться с иммуноглобулинами класса М или G. C3b связывается с поверхностью болезнетворных микроорганизмов, что приводит к большей «заинтересованности» фагоцитов к связанным с СЗb клеткам (опсонизация). C5a — важный хемоаттрактант, помогающий привлекать в район активации системы комплемента новые иммунные клетки. И C3a, и C5a имеют анафилотоксическую активность, непосредственно вызывая дегрануляцию тучных клеток (как следствие — выделение медиаторов воспаления). C5b начинает формирование мембраноатакующих комплексов (МАК), состоящим из C5b, C6, C7, C8 и полимерного C9. МАК — цитолитический конечный продукт активации системы комплемента. МАК формирует трансмембранный канал, вызывающий осмотический лизис клетки-мишени. Макрофаги поглощают помеченные системой комплемента болезнетворные микроорганизмы. Классический путь Классический путь запускается активацией комплекса С1 (он
включает одну молекулу С1q и по две молекулы С1r и С1s).
Комплекс С1 связывается с помощью С1q с иммуноглобулинами
классов М и G, связанными с антигенами. Гексамерный C1q по
форме напоминает букет нераскрытых тюльпанов, «бутоны» которого
могут связываться с Fc участком антител. Для инициации этого
пути достаточно единственной молекулы IgM, активация молекулами
IgG менее эффективна и требует больше молекул IgG.
Альтернативный путь
Альтернативный путь запускается гидролизом C3 прямо на
поверхности патогена. В альтернативном пути участвуют факторы В
и D. С их помощью происходит образование фермента СЗbВb.
Стабилизирует его и обеспечивает его длительное
функционирование белок P. Далее РС3bВb активирует С3, в
результате образуется С5-конвертаза и запускается образование
мембраноатакующего комплекса. Дальнейшая активация терминальных
компонентов комплемента происходит так же, как и по
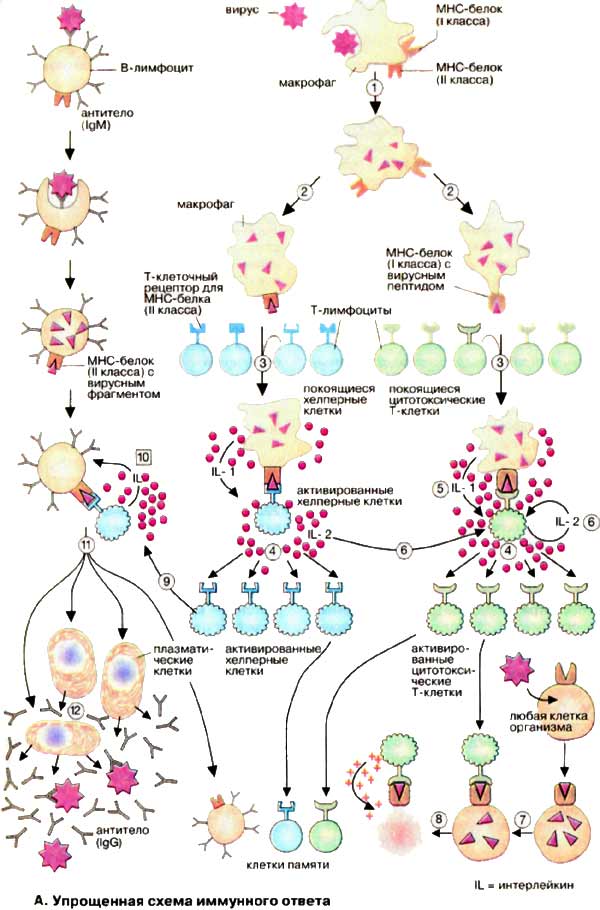
классическому пути активации комплемента. Лектиновый (маннозный) путь активации системы комплемента Маннан (маннан — полимер маннозы)-связанный лектиновый путь гомологичен классическому пути активации системы комплемента. Этот путь использует маннан-связывающий лектин (MBL)- белок, подобный C1q классического пути активации, который связывается с маннозными остатками и другими сахарами на мембране, что позволяет распознавать разнообразные болезнетворные микроорганизмы. MBL — белок, принадлежащий к коллектиновой группе белков, которая производится печенью и может активировать каскад комплемента, связываясь с поверхностью патогена. MBL — 2-6-вершинная молекула, которая формирует комплекс с MASP-I (Mannan-binding lectin Associated Serine Protease, MBL-связанная сериновая протеаза) и MASP-II. MASP-I и MASP-II весьма схожи с C1r и C1s классической пути активации и, возможно, имеют общего эволюционного предшественника. Когда определяющие углеводы вершины MBL связываются с определенным образом ориентированными маннозными остатками на фосфолипидном бислое болезнетворного микроорганизма, MASP-I и MASP-II активируются и расщепляют белок C4 на C4a и C4b, а белок С2 на C2a и C2b.Затем C4b и C2a объединяются на поверхности болезнетворного микроорганизма, формируя C3-конвертазу, а C4a и C2b действуют как хемоаттрактанты.Клеточный иммунный ответ Проникший в
организм вирус эндоцитируется макрофагами и затем частично
разрушается в эндоплазматическом ретикулуме (1). В результате
образуются чужеродные фрагменты, которые экспонируются на
клеточной поверхности макрофагов (2). Эти фрагменты
«презентируются» специальной группой мембранных белков (белки
ГКГС). Комплекс из вирусного фрагмента и белка
главного комплекса гистосовместимости [ГКГС (МНС)] распознается
и связывается Т-клетками с помощью специфических (Т-клеточных)
рецепторов. Среди огромного числа Т-клеток только немногие
обладают подходящим рецептором (3), Связывание приводит к
активации этих Т-клеток и появлению их селективных копий (4,
"клональная селекция"). В активации Т-клеток участвуют
различные гормоноподобные Сигнальные белки, интерлейкины [ИЛ
(IL), см. с. 378]. Эти белки секретируются теми клетками
иммунной системы, которые активируются при связывании с
Т-клетками. Так, активированные макрофаги с презентируемым
вирусным фрагментом секретируют IL-1 (5), а Т-клетки
продуцируют IL-2 (6), который стимулирует их собственное
клональное копирование и репликацию Т-хелперных клеток.
|
|
||||||||